Salwati SHUIB PhD, Nenny Noorina SAAID MMedSc, Zubaidah ZAKARIA* MBBS, DCP, Juriza ISMAIL **
MBBS, MMed and Zarina ABDUL LATIFF** MMed, MSc
マレーシア国民大学医療センター病理学部門、*医療研究所がん研究センター血液学ユニット、**マレーシア国民大学医療センター小児科、クアラルンプール。
要約
重複17p11.2症候群、トリソミー17p11.2またはdup(17)(p11.2p11.2)症候群としても知られるPotocki‐Lupski症候群(PTLS)は、発達障害およびまれな隣接遺伝子症候群であり、出生20,000人に1人が罹患する。 このような患者の主な特徴は、自閉症スペクトラム障害、学習障害、発達遅延、注意欠陥障害、乳児筋緊張低下および心血管異常である。 マイクロアレイを用いた以前の研究では、染色体17p11.2の重複領域の大きさおよび範囲の変異が同定された。 しかしながら、RAI1、SREBF1、DRG2、LLGL1、SHMT1およびZFP179を含む、PTLSの候補と考えられる少数の遺伝子がある。 本報告では、発達遅延を有する3歳女児の症例を調査した。
彼女の染色体分析は正常な核型(46,XX)を示した。 アレイCGH(4X44 K、Agilent USA)を用いた解析により、染色体17p11.2における約4.2 Mbの新規重複が同定された。 その結果は、臨界PTLS領域のプローブを用いた蛍光in situハイブリダイゼーション(FISH)によって確認された。
本報告は、PTLSの診断におけるマイクロアレイとFISHの重要性を示す。
キーワード: Potocki-Lupski症候群、重複17p11.2、マイクロアレイ、発生遅延、蛍光in situハイブリダイゼーション
はじめに
Potocki Lupski症候群(PTLS)としても知られる染色体17p11.2重複症候群(OMIM #610883)は、Brownら1によって初めて記載された。 その後、マイクロアレイのような高分解能法の出現により、より多くの患者が報告された。2, 3 PTLS領域の分子解析は、それがSmith Magenis症候群において欠失された同じ領域であることを示した。
(OMIM #182290)は、見かけのフラグメントサイズを有するユニークな接合フラグメントからなる。 この領域はまた、起源が優先的に父系であり、非対立遺伝子相同組換え(NAHR)機構4 によって生じると記述された。 患者の大多数は17p11.2の範囲内で共通の3.7 Mb重複を有し、残りは1.3~15.2 Mbの範囲の非再発性重複を有していた。 重要なPTLS領域は、レチノイン酸誘導性1(RAI1)遺伝子および他の17遺伝子3 を含む1.3 Mbの長さとして同定された。
PTLS患者の一般的な表現型は、筋緊張低下、摂食不良、発育不全、乳児期の発達遅滞、言語障害、幼児期の多動、知的障害、年長児の自閉症および行動障害、および心血管系の問題である。5, 6 重複領域の大きさの変動で、PTLS患者の臨床的特徴における広範な多様性および重症度が説明できる。 本研究では、著者らは全般的な発達遅延を有する小児における微小重複17p11.2を同定した。 重複のサイズは4.2 Mbと推定され、これはPTLSの共通および臨界領域と重なる。
症例報告
患者は3歳女児で、非血縁結婚の2番目の子であった。 彼女は、多動、発達遅滞、中枢性筋緊張低下および体重増加不良の問題を伴うUKMMCの小児発達センター(CDC)に来院した。 出生時体重2890gの帝王切開により満期産となった。 母親は39歳で、妊娠中に妊娠糖尿病と診断された。 乳児期初期には、患者は活動的であったが、授乳中にゆっくりした吸乳をしていた。 生後48時間目、患者は低血糖に続発する呼吸抑制のため新生児集中治療室に入院した。 患者は理学療法部に紹介され、2歳で歩行を開始した。 彼女は走り、階段を上り、一歩ずつ歩くことができたが、階段を下りることはできなかった。 彼女は11語の言葉を意味をもって話すことができ、単純な指示に従うことができた。 彼女は自分で食事をとることができず、毎日遺尿、夜尿があった。 聴力および眼の評価は正常であった。
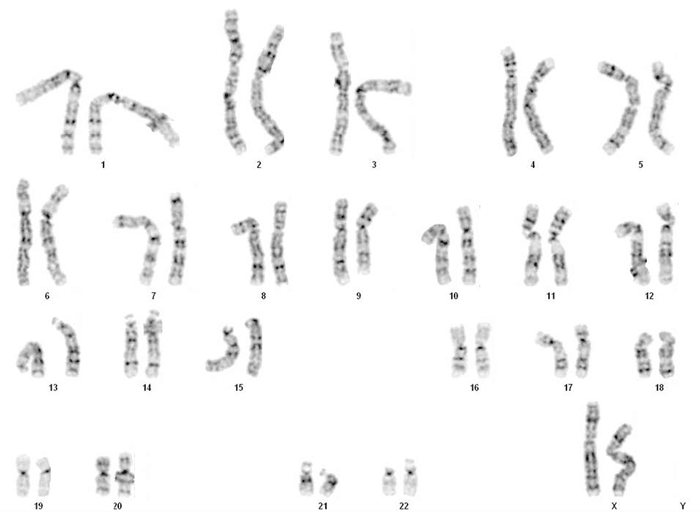
本症例報告では両親からインフォームドコンセントを得た。 研究プロトコールおよびインフォームド・コンセントは、University Kebangsaan Malaysia Research Committee Boardにより承認された。 遺伝学的所見 血液リンパ球培養は、標準プロトコールに従って患者の血液試料から調製した。 ギムザバンド染色体を、半数体(bph)分解能550バンドで正常な雌核型を示す20の中期から分析した(図1)。
ゲノムDNAは、DNeasy Blood & Tissueキットを用いて、製造業者の推奨手順(ドイツ、Qiagen)に従って患者の血液試料から抽出した。 標準サンプルとして通常の市販の雌gDNA(Agilents Technologies, USA)を使用した。 DNAの質および量は、1.0%アガロースゲル中での電気泳動およびNanoDrop UVVIS分光光度計(Nanodrop Tech)を用いて評価した。 それぞれ、米国 Agilent’s Direct Method of Oligo Array CGHワークフロー(Agilent Technologies, USA)に従い、Agilent Human Genome 4x44Kオリゴヌクレオチドアレイスライド上でアレイCGHを実施した。 マイクロアレイ解析の結果、染色体17p11.2上で約4.2 Mbの重複が検出された(図2)。
重複の開始点および停止点は、それぞれ、16,782,546および21,050,337 kbと推定された。 この領域は、重要なPTLS領域の遺伝子を含む122個のRefSeq遺伝子を含む。

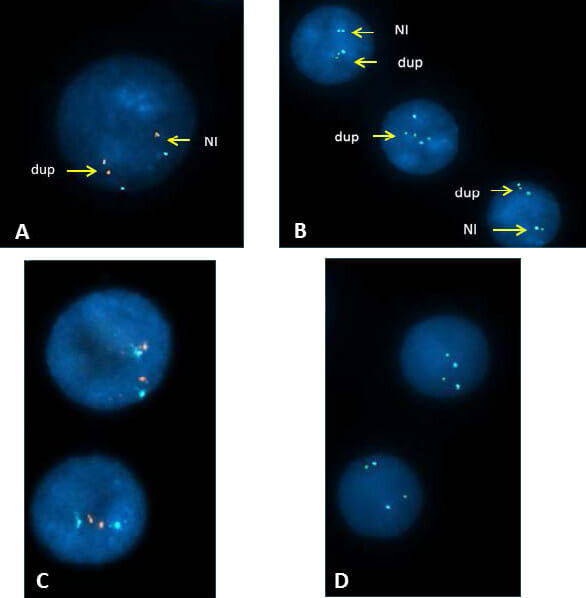
これまでの報告およびゲノム変異型データベースの内容を考慮すると(http://dgv.tcag.ca/gb2/gbrowse/dgv2_hg19/)、この重複はポトッキー-ルプスキー症候群重複の特徴と考えられ、用量感受性RAI1遺伝子を含む)、 マイクロアレイの結果を確認するために、特異的プローブAgilent SureFISH 17p11.2 GLL1-SHMT1(スペクトル赤)、Agilent SureFISH 17p11.2 RAI1(スペクトル緑)および対照Agilent SureFISH 17 CEP BL(スペクトルアクア)を用いてFISHを行った。 分析した150核でのハイブリダイゼーションの結果は、RAI1およびSHMT1遺伝子座の重複の証拠を示し、マイクロアレイの所見を確認した。
両親とも正常な核型(データは示していない)と正常なFISHシグナルパターン、すなわち赤色2個、緑色2個、アクア2個をもつ(図3)。
考察
アレイCGHは、高解像度(≦1 Mb)で、コピー数の変異(増幅または欠失)および全染色体およびゲノムにわたる単一コピーの増減を同定し、ヒトゲノムの物理的および遺伝的地図に関連する正確な位置情報を可能にする。7 この技術は、より費用対効果が高く、手頃な価格になり、中所得国を含む多くの研究所が、学習障害のある患者における第一選択の診断検査として利用し始めた。8 しかし、この技術ではバランスのとれた転座を同定できないことに留意することが重要であり、したがって、学習障害および先天異常を有する患者の調査には常に従来の核型分析を含めなければならない。
国際標準細胞ゲノムアレイ(ISCA)コンソーシアムが実施した調査のエビデンスによれば、発達遅滞/知的障害、自閉症スペクトラム障害、および多発性先天異常を有する患者の第一段階の細胞遺伝学的診断検査として、染色体マイクロアレイを適用すべきである。これは主に、従来のGバンド解析と比較して感度が高いためである。9 さらに、学習障害(精神遅滞)および先天異常を有する被験者13,926人を対象とした大規模な系統的レビューにより、核型判定が正常なこのような患者の研究にアレイCGHをルーチンに使用することを支持するエビデンスが得られている。 しかし、この研究では、結果の解釈には注意が必要であることも示唆されている。なぜなら、この技術では原因変異体と同程度の割合で偽陽性も同定されるからである。8
マイクロアレイとFISHによる検証を用いて、著者らはPTLSに関連する著者らの患者において約4.2 Mbの重複17p11.2を同定した。 著者らの患者で同定された重複領域は、PTLSの3.4 Mb共通領域と1.3 Mb臨界領域と重複している(図2)。 PTLSの一般的な表現型に加えて、著者らの患者は新生児低血糖を有していることも指摘された。 糖尿病(妊娠糖尿病、妊娠前糖尿病)の女性では、低血糖の子供が生まれるリスクが高いことはよく知られている。 従って、著者らの患者における新生児低血糖は、重複の影響よりもむしろ母親の妊娠糖尿病に起因する可能性が最も高い。 両親の血液サンプルに対して実施したFISH分析および核型分類は正常な結果を示し、この患者におけるPTLSがde novo事象として発生したことを示した。
報告されたPTLS症例の大多数はde novoであるが、現在までに遺伝性PTLSの2つの報告(3家系)がある。10, 11 最近、Leeら12 は、微妙なPTLS表現型を有する男児において、最短の0.25 Mb(17,575,978-17,824,623)重複17p11.2を発見した。 重複領域は重要なPTLS領域内にあり、RAI1、SMCR5、SREBF1およびTOM1L2の4つの遺伝子のみを含む。 以前の報告と一致して、彼らは、PTLS表現型の主な臨床的特徴に関与する重要な用量感受性遺伝子としてRAI1、および別の潜在的候補遺伝子としてSREBF1であることを示唆した。 しかし、PTLSがRAI1またはSREBF1遺伝子座のみの重複によって引き起こされるかどうかは依然として不明である。 マウスモデルの研究はまた、Rai1がPTLSの表現型に関与する重要かつ用量感受性遺伝子であるという証拠を提供している。13, 14
結論として、著者らの知見は、ルーチンのギムザバンド(Gバンド)染色体のみを分析した場合に見逃されたであろう17p11.2重複(PTLS)の同定と確認におけるアレイCGHと間期FISHの重要性を示した。 一倍体解像度(bph)あたり550バンディングで、5 Mb以上の欠失または付加を含む染色体異常を検出することができるが、より小さな異常(<5 Mb)では、より高いバンド解像度、または代替的に、FISH、アレイCGH、配列決定またはNGSのようなより特殊化した技術が、この染色体再配列を解明するための最良のアプローチであろう。
謝辞
本治験にご参加いただいた患者様、ご両親の皆様に感謝申し上げます。 また、UKMMC病理部細胞遺伝学ユニットのスタッフの技術的な態度と支援に感謝申し上げます。 本研究は、UKM-GUP-2011-320およびFF-2013-329に対して、ケバンザン大学マレーシア校から助成を受けた。
著者は、利益相反がないことを宣言する。
参考文献
- Brown A, Phelan MC, Patil S, Crawford E, Rogers RC, Schwartz C. 17p11.2の重複患者2例: Smith-Magenis症候群欠失の逆数? Am J Med Genet. 1996; 63: 373-7.
- Potocki L, Chen KS, Park SS, et al. 重複の分子機構17p11.2-Smith-Magenis微小欠失の相同組換え相互。 ナットジェネット 2000; 24: 84-7.
- Potocki L, Bi W, Treadwell-Deering D, et al. Potocki-Lupski症候群(dup(17)(p11.2p11.2))の特徴づけおよび自閉症の表現型を伝えることができる用量感受性臨界間隔の描出。 Am J Hum Genet. 2007; 80: 633-49.
- Zhang F, Potocki L, Sampson JB, et al. まれに再発するPotocki-Lupski症候群関連重複の同定、およびPTLSにおける再構成のタイプと機序の分布。 Am J Hum Genet. 2010; 86: 462-70.
- Soler-Alfonso C, Motil KJ, Turk CL, et al. PotockiLupski症候群:口腔咽頭障害および発育不全と関連する微小重複症候群。 J Pediatr. 2011; 158: 655-9.
- Jefferies JL, Pignatelli RH, Martinez HR, et al. 重複17p11.2症候群における心血管所見。 Genet Med. 2012; 14: 90-4.
- Cheung SW, Shaw CA, Yu W, et al. 臨床的細胞遺伝学的診断のためのCGHマイクロアレイの開発と検証。 Genet Med. 2005; 7: 422– 32.
- Sagoo GS, Butterworth AS, Sanderson S, ShawSmith C, Higgins JP, Burton H. Array CGH in 学習障害(精神遅滞)および先天異常の患者: 19件の研究および13,926例の最新のシステマティック・レビューおよびメタアナリシス。 Genet Med. 2009; 11:139-46.
- Miller DT, Adam MP, Aradhya S, et al. コンセンサス声明:染色体マイクロアレイは、発達障害または先天異常を有する個人に対する第一段階の臨床診断検査である。 Am J Hum Genet. 2010; 86: 749–64.
- Yusupov R, Roberts AE, Lacro RV, Sandstrom M, Ligon AH. Potocki-Lupski症候群:左心低形成を伴う遺伝性複製(17)(p11.2p11.2)。 Am J Med Genet A. 2011; 155A: 367-71.
- Magoulas PL, Liu P, Gelowani V, et al. 遺伝性dup(17)(p11.2p11.2):Potocki-Lupski症候群の表現型を拡大する。 Am J Med Genet A. 2014; 164A: 500-4.
- Lee CG, Park SJ, Yim SY, Sohn YB. RAI1を含む17p11.2における最も短い0.25 Mbの微小重複を伴うPotocki-Lupski症候群の臨床的および細胞遺伝学的特徴。 脳部 2013; 35: 681-5.
- Walz K, Paylor R, Yan J, Bi W, Lupski JR. Rai1の重複は、dup(17)のマウスモデルにおいて物理的および行動的表現型を引き起こす(p11.2p11.2)。 J Clin Invest. 2006; 116: 3035-41.
- Carmona-Mora P, Walz K. Retinoic Acid Induced 1, RAI1: 自閉症行動を含む神経行動変化に関連する用量感受性遺伝子。 カーゲノミクス 2010; 11: 607-17.
連絡先: Dr. Salwati Shuib, Cytogenetic Unit, Department of Pathology, Jalan Yaacob Latif, Bandar Tun Razak, Universiti Kebangsaan Malaysia Medical Centre (UKMMC), Cheras 56000 Kuala Lumpur, Malaysia。 電話番号: 603-91459511、FAX番号: 603-91459485 メール: salwati@ ppukm.ukm.edu.my